Uma história de sucesso e evolução na Medicina
Como de uma patologia invariavelmente fatal sem o transplante de células tronco passou a ter sobrevida semelhante a da população geral.
Imagine uma doença que não manifesta sintomas e que evolua gradativamente para um quadro clínico que passará a ter distensão do abdome por causa de significativo aumento de baço, perda de peso e fraqueza. A medida que a doença progride, sem o tratamento, passa a ter anemia, assim piorando a fraqueza. Isso faz o nosso paciente imaginário procurar um médico e ao primeiro momento de avaliação o profissional nota o baço e fígado aumentados. O paciente refere que esse processo vem há mais de um ano.
Isso mesmo muitos pacientes demoram de procurar assistência médica devido aos sintomas serem muito inespecíficos. Era assim há alguns anos e melhorou mais atualmente, mas a demora ainda ocorre.
Quando se realiza exames laboratoriais nota-se aumento do glóbulos brancos, dos neutrófilos, sinal comum nas leucemias mieloide crônicas em que, exceto pela quantidade de células, não há distinção na forma do leucócitos. Pode ocorrer alguns mais imaturos que outros numa situação que chamamos desvio à esquerda.
Um pouco de história…
A história dos casos de LMC como nós conhecemos é conhecida a partir da descrição de patologistas John Bennet e Rudolf Virchof em cerca de 1845. Naquela época eles descreveram quase que simultaneamente caos clínicos muito parecidos com o nosso exemplo em que pacientes possuíam aumento de baço e fígado além de leucocitose. Foi Virchow que cunhou o termo leucemia, sangue branco, e a LMC teve seu primeiro nome como Leucemia Granulocítica Crônica. Outra descoberta muito significativa foi realizada por Ernst Neumann, em 1872, que afirmou no seu relato que a leucemia era oriunda da medula óssea. Foi dele a ideia que temos hoje de uma célula-tronco da medula óssea.




A história mais atual década dos anos 1960, quando um pequeno cromossomo foi descoberto a partir da análise de cariótipo de 2 pacientes com LMC, que era o cromossomo 22 mais curto. Esse achado viria ser chamado de cromossomo Filadélfia, por causa da origem de quem descobriu, apesar de relatos anteriores também já terem descrito o mesmo achado. Lembremos que estamos em 1960 e a comunicação não é como hoje em que rapidamente as informações são compartilhadas pelo mundo. Uma grande descoberta veio nos anos a seguir, em 1973, a partir da coloração de Giemsa e o cariótipo em bandas. Janet Rowley, de Chicago, foi quem descreveu e pasmem… ela teve o artigo rejeitado na tentativa de publicá-lo. Isso mesmo meu caro seguidor, não podemos desistir de primeira, ainda mais se sabemos da importância daquilo que estamos produzindo. Sua descoberta descrevias a constatação de outro cromossomo alterado, o 9, havendo assim o primeiro relato de uma alteração genética estabelecida em um tipo específico de câncer. A referida alteração é uma translocação e envolve a troca de material genético entre um cromossomo e outro. Posteriormente a avaliação molecular descreveu os locais mais específicos do cromossomo e foi assim o gene produto da fusão foi denominado de BCR-ABL1, que também depois foi visto que não era exclusivo da LMC. E para confirmar que esse gene estava envolvido na causa da LMC, a transposição do gene por meio de um vetor viral à camundongos provocava doença mieloproliferativa nesses.


E o tratamento…
O tratamento também passou por mudanças significativas. Na verdade, o sucesso do tratamento da LMC é buscado em outros tipos de malignidades a partir da descoberta de um gene que pode ser alvo de terapia específica como é o caso dessa doença.

No início dos anos 1900 terapias como arsênico, radioterapia do baço. O primeiro foi utilizado em 1865, apesar de haver relatos de uso há mais de 2000 anos. Há um relato de caso clínico feito por Dr. Arthur Conan Doyle, isso mesmo, o escritor famoso por obras do Sherlock Holmes, descreveu uma situação em que a paciente foi tratada com arsênico e o desfecho não foi satisfatório, afinal não se conhecia aquela rara doença.
Outra modalidade de tratamento foi a esplenectomia, mas os resultados foram desastrosos, pois havia complicações hemorrágicas seríssimas no pós-operatório. A radioterapia foi outra possibilidade terapêutica utilizada, era uma inovação tecnológica, desde a descoberta da radioatividade buscava-se uso útil da novidade científica e a medicina não foi distinta. A radiação do baço provocava, principalmente naqueles pacientes com diagnóstico mais inicial, respostas clínicas, fazendo o paciente inclusive retornar às atividades diárias. Mas a radiação não modificava a origem da doença, tratava apenas os sintomas. Até mesmo depois da aceitação que as leucemias possuem origem na medula óssea foram instituídas novas formas de tratamento com a irradiação de outros lugares, mas a resposta dessa terapia foi muito limitada.
Tudo começou a mudar um pouco já em meados do século XX. Durante a I Guerra Mundial foi notado que agentes químicos utilizados em combate, como o gás mostarda, possuía efeitos hematopoiéticos, ou seja, afetava, no caso reduzindo, a produção de sangue. Outros compostos foram descobertos, seja nitrogenados ou sulfurados, no período entre guerras. O uso médico veio mesmo a partir do final da II Guerra Mundial, quando experimentos em pacientes com leucemias crônicas provocavam mielossupressão severa. Em 1956 foi introduzido um derivado aquilante, chamado de bulsufam, que após diversos estudos mostrava como uma ferramenta capaz de controlar eficientemente a LMC, mais conveniente que a radioterapia.
O bulsufam teve seu uso por longo período, até o início da utilização de hidroxiureia e interferon-alfa, ambas ainda disponíveis para uso atualmente, em situação raras e específicas. A hidroxiureia era capaz de provocar de forma mais segura que o bulsufam, que tinha toxicidade cumulativa significativa, o controle clínico da doença, ou seja dos sintomas, a partir do controle sanguíneo. O interferon-alfa, introduzido nos anos 1980, para o tratamento da LMC foi uma transformação para a terapia daquela doença, pois permitia, pela primeira vez modificação do tempo de sobrevida naqueles respondedores, pois era capaz de “mexer” na origem genética da doença, criando o conceito da resposta citogenética.
A difícil e custosa cura…
Apesar dos avanços terapêuticos progressivos que LMC assistiu na sua trajetória histórica, a palavra cura existia, mas num círculo bastante limitado de pessoas. Até os anos 1970 a LMC era incurável e invariavelmente fatal. O ponto de inflexão iniciou a existência no momento em que um tratamento, que para muitos seria um delírio ou mesmo um sonho maluco, tornou-se realidade. Estamos falando do Transplante de Medula Óssea, hoje conhecido como Transplante de Células Tronco. Como muitas coisas na Medicina ocorrem de forma incidental, algo similar também ocorreu com a LMC. Como assim?
O bulsufam, ao qual nos referimos anteriormente, é uma droga com perfil de toxicidade significativo e alguns pacientes que tinham a mielossupressão oriunda do uso do tratamento experimentavam também prolongada remissão da doença, alguns reportando até mesmo extinção parcial do cromossomo Filadélfia. Claro que foi tentado utilizar isso como se fosse uma esquema de quimioterapia, mas não deu resultado adequado. Faltava algo. Esse algo foi descrito por Goldman em 1986 quando lançou a pedra fundamental daquela terapia que seria a única curativa para LMC, o transplante. É ainda uma possibilidade de tratamento nos dias atuais, com uso bastante restrito e indicação cada vez mais criteriosa. Os primeiros resultados foram meio desapontadores, mas o aprendizado e a descrição do efeito GVL, como é conhecida a “batalha imunológica” da medula óssea saudável contra a doença o chamado “Enxerto versus Leucemia” seria também descrito como a chave da cura. Porém esse tratamento não estava ao alcance de todos, pois nem todos possuíam doadores e nem a idade que permitisse o uso dessa modalidade de tratamento.
A virada de chave
Como muitas malignidades a LMC tinha um tratamento para controle temporário da doença e uma possibilidade de cura, às custas de bastante morbidade e limitada a poucos. Estudos científicos em busca de medicações que poderiam inibir tirosinocinases tornaram-se realidade. As tirosinocinases são um grupo de proteínas do interior da célula que possuem diversas funções, mas comumente tem a capacidade de transmitir a informação da sua função por meio de fosforilação, ou seja, acrescentando fósforo. O gene produto da fusão dos genes BCR-ABL, envolvido na origem da LMC, possui atividade tirosinocinase, logo poderia ser uma alvo para medicamentos. O problema até então é que medicamentos que vinham sendo criados possuíam atividade inibitória bastante fraca ou inibiam também os sítios do ATP, uma reserva de energia para célula, e assim o resultado, como esperado, não seriam bons. Isso começou a modificar com a descoberta de medicamentos como ciclosporina e rapamicina que atualmente ainda são utilizados como imunossupressores e provocaram modificações substanciais na abordagem terapêutica da medicina de transplantes de órgãos. Isso despertou o interesse pela pesquisa e desenvolvimento de drogas que atuariam em proteínas envolvidas na proliferação celular, haja vista que muitas são dependentes de tirosinocinases. A primeira droga liberada com esse fim foi Imatinibe (chamado Gleevec) em maio de 2001, mas seu desenvolvimento data 1986 e seus estudos mais robustos iniciaram de fato no fim dos anos 1980, sob o nome STI-571. Somente em 1996 estudos clínicos em humanos iniciaram, daí podemos notar como é um processo de descoberta de uma molécula até o uso comercial dela pode demorar bastante tempo, e afirmo que a liberação do imatinibe, foi acelerada em relação a algumas outras drogas, devido a LMC ser considerada uma patologia sem tratamento adequado naquela época.
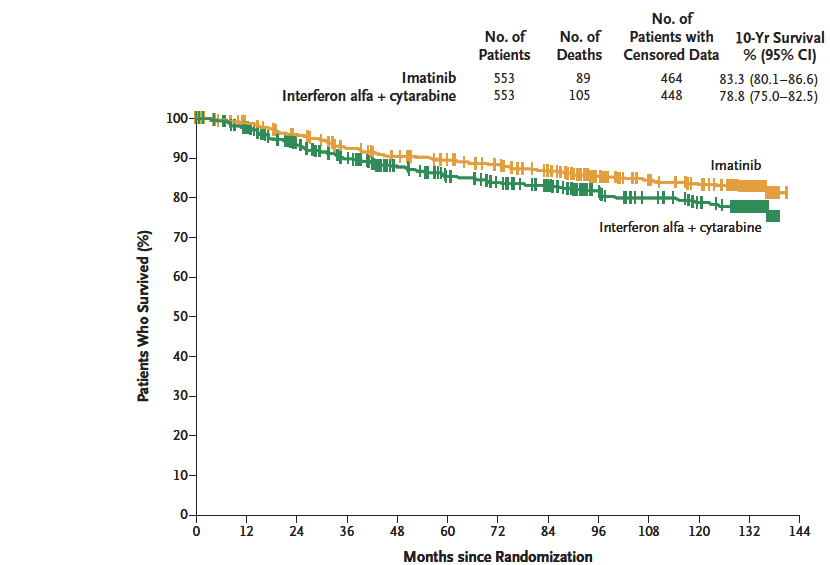
O que nós temos depois do uso clínico aprovado nos EUA é a realidade atual, não mais história. A LMC teve uma mudança total da sua forma de tratamento, permitindo pacientes ter a sua vida similar àqueles que não possuem a doença.
Hoje dispomos de diversas drogas que podem ser utilizadas em primeira linha e em casos onde não há resposta adequada ao tratamento anterior. O transplante continua sendo uma ferramenta terapêutica em situações bastante específicas, mas pouco utilizada. Hoje a vida do paciente é melhor porque apenas com medicações orais pode se alcançar resultados antes impensáveis devolvendo ao paciente a possibilidade de trabalhar, realizar suas atividades normalmente. Ainda que seja necessário a realização de avaliações médicas regulares e exames laboratoriais isso é muito aquém de todo incômodo oriundo das terapias mais antigas.
A LMC teve uma mudança total da sua forma de tratamento, permitindo pacientes ter a sua vida similar àqueles que não possuem a doença.
Se gostar do conteúdo compartilhe ele para o seus amigos e quem tiver interesse sobre esse conteúdo.